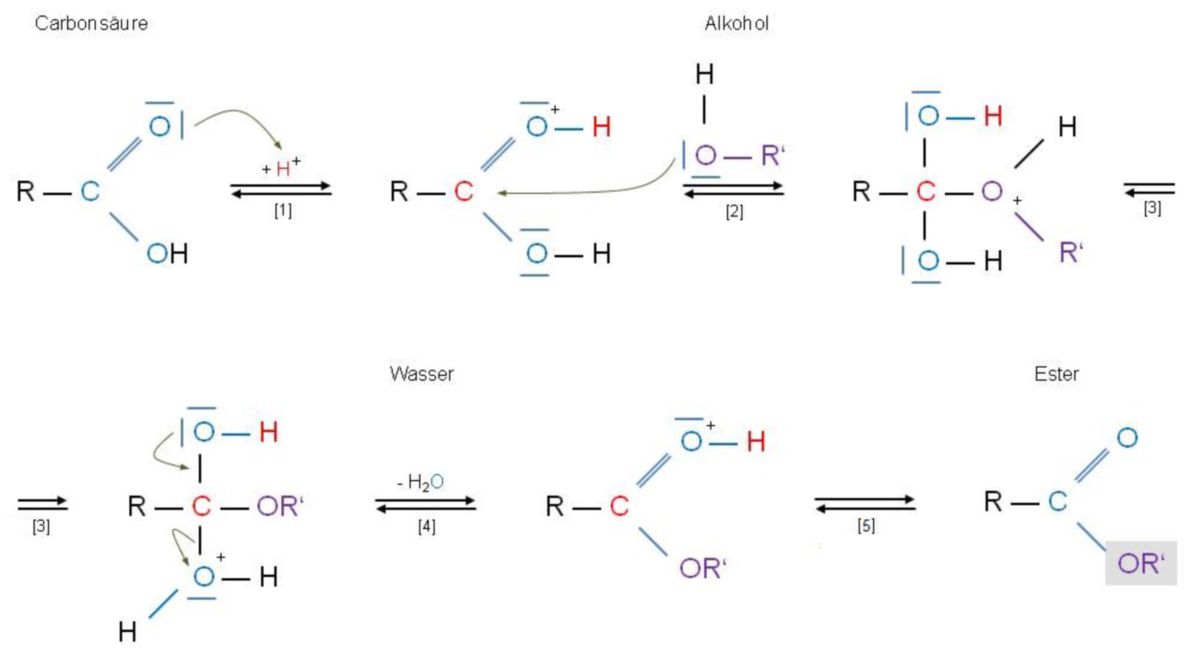
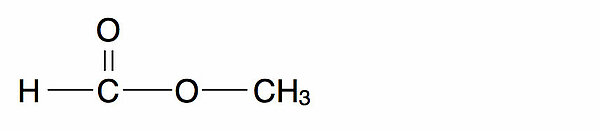Kohlensäuredimethylester oder Dimethylcarbonat ist eine organische chemische Verbindung, die als Dimethylester der Kohlensäure gesehen werden kann.
Darstellung und Gewinnung
Dimethylcarbonat kann in einer Zweiphasenreaktion durch Umsetzung von Methanol mit Phosgen oder Methylchlorformiat in konzentrierter Natronlauge gewonnen werden. Eine modernere Synthese verläuft als direkte oxidative Carbonylierung von Methanol mittels Kohlenmonoxid und Sauerstoff in Gegenwart von Kupferkatalysatoren.
Eigenschaften
Physikalische Eigenschaften
Dimethylcarbonat ist eine leichtentzündliche, farblose Flüssigkeit. Bei Normaldruck siedet die Verbindung bei 90 °C. Der kritische Punkt wird bei einer Temperatur Tc = 284 °C und einem Druck Pc = 48 bar mit einer kritischen Dichte von 3,97 kg·l−1 erreicht.
Sicherheitstechnische Kenngrößen
Dimethylcarbonat bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt von 14 °C. Der Explosionsbereich liegt zwischen 3,26 Vol.‑% (122 g/m³) als untere Explosionsgrenze (UEG) und 12,87 Vol.‑% als obere Explosionsgrenze (OEG). Die Sauerstoffgrenzkonzentration liegt bei 8,0 %. Die Zündtemperatur beträgt 458 °C. Der Stoff fällt somit in die Temperaturklasse T1.
Verwendung
Im Gemisch mit Ethylencarbonat wird die Verbindung in nichtwässrigen Elektrolytlösungen für Lithiumbatterien verwendet. In der organischen Synthese wird Dimethylcarbonat als Methylierungsreagenz eingesetzt. Außerdem ersetzt es zunehmend das sehr giftige Phosgen bei der Herstellung von Polycarbonat-Kunststoffen. Die Verwendung als Kraftstoffkomponente wird diskutiert.
Einzelnachweise